1. PROPIEDADES DE LA MATERIA
La materia es todo aquello que tiene un lugar en el espacio, contiene una cierta cantidad de energía, y está sujeta a cambios en el tiempo, y a interacciones con aparatos de medida.
En física y filosofía, materia es el término para referirse a los constituyentes de la realidad material objetiva, entendiendo por objetiva que pueda ser percibida de la misma forma por diversos sujetos.
Se considera que es el que forma la parte sensible de los objetos perceptibles o detectables por medios físicos. Es decir, es todo aquello que ocupa un lugar en el espacio, se puede tocar, se puede sentir, se puede medir, etc.
1.1. Propiedades Generales de la Materia
Las presentan los cuerpos sin distinción y por tal motivo nos permiten diferenciar una sustancia de otra. A algunas de las propiedades generales, se les da el nombre de extensivas, porque su valor depende de la cantidad de materia: tal es el caso de la masa, peso, volumen, la inercia, la energía, impenetrabilidad, porosidad, divisibilidad, elasticidad, maleabilidad, tenacidad y dureza, entre otros.
Propiedades y características.
Permiten distinguir una sustancia de otra. También reciben el nombre de propiedades intensivas porque su valor es independiente de la cantidad de materia. Las propiedades características se clasifican en:
- Físicas.
Es el caso de la densidad, el punto de fusión, el punto de ebullición, el coeficiente de solubilidad, el índice de refracción, el módulo de Young y las propiedades organolépticas.
- Químicas.
Están constituidas por el comportamiento de las sustancias al combinarse con otros, y los cambios en su estructura íntima como consecuencia de los efectos de diferentes clases de energía.
Ejemplos: corrosión de ácidos, poder calorífico, acidez, reactividad.
1.2. Ley de la Conservación de la Materia.
Como hecho científico, la idea de que la masa se conserva se remonta al químico Lavoisier, el científico francés considerado padre de la química moderna, que midió cuidadosamente la masa de las sustancias antes y después de intervenir en una reacción química, y llegar a la conclusión de que la materia, medida por la masa, no se crea ni destruye, sino que sólo se transforma en el curso de las reacciones.
Sus conclusiones se resumen en el siguiente enunciado: En una reacción química, la materia no se crea ni se destruye, sólo se transforma.
El mismo principio fue descubierto antes por Mijail Lomonosov, por lo que es a veces citado como ley de Lomonosov-Lavoisier, más o menos en los siguientes términos: la masa de un sistema de sustancias es constante, con independencia de los procesos internos que puedan afectarla, es decir, “la suma de los productos es igual a la suma de los reactivos, y se mantiene constante la masa“.
Sin embargo, tanto las técnicas modernas como la mejora de la precisión de las medidas han permitido establecer que la ley de Lomonosov-Lavoisier se cumple sólo aproximadamente.
La equivalencia entre masa y energía descubierta por Einstein, obliga a rechazar la afirmación de que la masa convencional se conserva, porque masa y energía son mutuamente convertibles.
De esta manera, se puede afirmar que la masa relativista equivalente (el total de masa material y energía) se conserva, pero la masa en reposo puede cambiar, como ocurre en aquellos procesos relativisticos en que una parte de la materia se convierte en fotones.
La conversión en reacciones nucleares de una parte de la materia en energía radiante, con disminución de la masa en reposo, se observa por ejemplo en procesos de fisión como la explosión de una bomba atómica, o en procesos de fusión como el emisión constante de energía que realizan las estrellas.
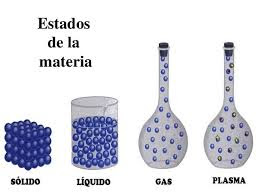
2. Los Estados de la Materia.
En física y en química, un estado de la materia, o fases, corresponde de hecho a una serie de estados macroscópicos, que tienen un conjunto de propiedades físicas y químicas relativamente uniformes (densidad, estructura cristalina, índice de refracción...). Históricamente, la diferenciación se hacía basándose en propiedades cualitativas como el volumen y la forma: el sólido era el estado en que la materia mantenía la forma y el volumen de forma permanente, el líquido mantiene un volumen fijo, pero se adapta a la forma del recipiente que lo contiene, y el gas el estado en que la materia se expande para ocupar todo el volumen disponible.
Estados clásicos.
Los tres estados más familiares de la materia, considerados como los estados clásicos, son:
- Sólido: En este estado, las sustancias mantienen en general su forma y volumen.
- Líquido: En este estado, las sustancias mantienen el volumen, pero la forma es inestable y se adapta a la superficies que lo rodean.
- Gaseoso: En este estado, las sustancias ocupan totalmente el espacio disponible.
En el caso de los sólidos, se diferencian dos tipos en función de otras características:
- Sólido cristalino: Es un sólido frágil que no cambia de forma, sus partículas se distribuyen ordenadamente y en posiciones fijas en el espacio. Sus componentes elementales son retículas o celdas cristalinas que se repiten.
- Sólido amorfo: Se caracteriza por el hecho de que las partículas que los forman se distribuyen al azar en el espacio.
Modelos de las partículas de los estados clásicos.
Las propiedades de tres estados clásicos de la materia se pueden explicar con modelos simples de la estructura de la materia, asumiendo que la materia está formada por partículas minúsculas.
En realidad, estas partículas (átomos, moléculas o iones) tienen diferentes formas; pero, para el propósito de evaluación de los estados de la materia, las podemos considerar como pequeñas esferas.
El promedio de la energía cinética de todas las partículas en cada uno de los estados es una medida de la temperatura. Pero la naturaleza del movimiento en cada estado de la materia es totalmente diferente.
En el gas, las partículas se mueven siguiendo líneas rectas, como si fueran bolas de billar, hasta que chocan entre sí o con la pared del recipiente contenedor.
En los líquidos, las partículas deben pasar por los espacios que dejan las partículas vecinas (difusión, movimiento browniano). En el estado sólido, las partículas sólo vibran alrededor de su posición de equilibrio.
2.1. Estado sólido.
Modelo de las partículas de un sólido cristalino.
Manteniendo constante la presión, a baja temperatura, los cuerpos se presentan en forma sólida de manera que los átomos se encuentran entrelazados formando generalmente estructuras cristalinas; esto confiere al cuerpo la capacidad de soportar fuerzas sin deformación aparente.
Son, por tanto, agregados generalmente rígidos, duros y resistentes. El estado sólido presenta las siguientes características:
- Fuerza de cohesión (atracción).
- Vibración.
- Tiene forma propia.
- Los sólidos no se pueden comprimir.
- Son resistentes a fragmentarse.
- Volumen definido.
- Puede ser orgánico o inorgánico.
- Tienen una densidad alta.
2.2. Estado líquido.
Modelo de las partículas de un líquido o un sólido amorfo.
Incrementando la temperatura, el sólido se va “descomponiendo” hasta desaparecer la estructura cristalina, y llega al estado líquido, cuya característica principal es la capacidad de fluir y adaptarse a la forma del recipiente que lo contiene.
En este caso, todavía existe un cierto vínculo entre los átomos del cuerpo, aunque de mucha menor intensidad que en el caso de los sólidos. El estado líquido presenta las siguientes características:
- Fuerza de cohesión menor (regular).
- Movimiento-energía cinética.
- Sin forma definida.
- Toma el volumen del envase que lo contiene.
- En frío se comprime, exceptuando el agua.
- Tiene fluidez.
- Puede presentar fenómeno de difusión.
Los líquidos tienen 3 estados: – gaseoso – líquido – sólido.
2.3. Estado gaseoso.
Modelo de las partículas de un gas.
Finalmente, incrementando aún más la temperatura, se llega al estado gaseoso. Los átomos o moléculas del gas se encuentran virtualmente libres, por lo que son capaces de ocupar todo el espacio del recipiente que lo contiene, aunque sería mejor decir que se distribuye o reparte por todo el espacio disponible. El estado gaseoso presenta las siguientes características:
- Fuerza de cohesión casi nula.
- Sin forma definida.
- Sin volumen definido.
- Se puede comprimir fácilmente.
- Ejerce presión sobre las paredes del recipiente que lo contiene.
- Los gases se mueven con libertad.
Ejemplos de estado físico de algunas sustancias
La siguiente tabla muestra el estado físico en que se encuentran una serie de sustancias seleccionadas a una presión de 1013,25 hPa (presión atmosférica) y en dos situaciones de temperatura, a 25 °C y -10 °C. En tanto que la presión se considera constante, los cambios son debidos sólo a la variación de la temperatura.
| Sustancia | Temperatura de fusión 1 | Temperatura de ebullición 1 | Estado físico a temperatura ambiente (25 ° C) 1 | Estado físico en un congelador (-10 ° C) 1 |
|---|---|---|---|---|
| hierro | 1535 ° C | 2750 ° C | sólido | sólido |
| cobre | 1084 ° C | 2.567 ° C | sólido | sólido |
| cesio | 28 ° C | 671 ° C | sólido | sólido |
| oxígeno | -219 ° C | -183 ° C | gaseoso | gaseoso |
| helio | -272 ° C | -269 ° C | gaseoso | gaseoso |
| bromo | -7 ° C | 59 ° C | líquido | sólido |
| cloro | -101 ° C | -35 ° C | gaseoso | gaseoso |
| agua | 0 ° C | 100 ° C | líquido | sólido |
1 a presión atmosférica
3. Cambios de estado.
Un cambio de estado o transición de fase es la evolución de la materia entre varios estados sin que haya cambios en la composición.
Para cada elemento o compuesto químico, existen unas determinadas condiciones de presión y temperatura en las que se producen los cambios de estado, debiendo interpretarse, cuando se hace referencia únicamente a la temperatura de cambio de estado, que esta se refiere a la presión de 1 atm (la presión atmosférica).
De esta manera, en condiciones normales (presión atmosférica y 20 °C), hay compuestos tanto en estado sólido, como líquido y gaseoso.
Las transiciones de fase se producen cuando la energía libre de un sistema no es una función analítica (no es continua o no es derivable, por ejemplo) para alguna de las variables termodinámicas.
Un cambio de estado o transición de fase es la evolución de la materia entre varios estados sin que haya cambios en la composición.
Para cada elemento o compuesto químico, existen unas determinadas condiciones de presión y temperatura en las que se producen los cambios de estado, debiendo interpretarse, cuando se hace referencia únicamente a la temperatura de cambio de estado, que esta se refiere a la presión de 1 atm (la presión atmosférica).
De esta manera, en condiciones normales (presión atmosférica y 20 °C), hay compuestos tanto en estado sólido, como líquido y gaseoso.
Las transiciones de fase se producen cuando la energía libre de un sistema no es una función analítica (no es continua o no es derivable, por ejemplo) para alguna de las variables termodinámicas.
Cuando una sustancia sufre un cambio de fase, cambia de un estado de la materia a otro, suele adquirir o liberar energía. Por ejemplo, cuando el agua se evapora, la energía cinética utilizada por las moléculas en evaporación para huir de la fuerza atractiva del líquido se refleja en un descenso de la temperatura.
La energía calorífica, o entalpía, asociada a un cambio de sólido a líquido, es la entalpía de fusión, mientras que la que está asociada a un cambio de sólido a gas es la entalpía de sublimación.
Las transiciones entre los diferentes estados físicos tienen nombres especiales (solidificación, sublimación, fusión, etc.) y hay unas condiciones específicas de presión y temperatura para que se pueda producir la transición en sustancias puras.
Estas condiciones de transición corresponden a las líneas que hacen de frontera entre fases en los diagramas de fase. Con cada cambio de fase, se produce la liberación o absorción de cierta cantidad de calor. Los posibles cambios de estado se muestran en la tabla siguiente:
- Ejemplos cotidianos:
Todas las transiciones de fase se pueden observar en la vida cotidiana, por ejemplo sobre el agua:
- Fusión: Si sacamos hielo del refrigerador, se empieza a licuar, porque la temperatura que hay fuera del congelador es superior a la temperatura de fusión del agua.
- Solidificación: Al poner agua en el congelador, el agua se enfría, al principio se forman cristales de hielo que van creciendo más y más hasta que el agua se convierte en una masa compacta de hielo.
- Evaporación: Si calentamos agua por encima de su temperatura de ebullición, se convierte en un gas. Las burbujas que observamos en hervir el agua son el resultado de la formación de vapor de agua (un gas) bajo la superficie.
- Condensación: El vapor de agua es, como la mayoría de las sustancias gaseosas, invisible. Enfriando el vapor de agua en estado gaseoso, aparecen pequeñas gotas de agua que son visibles.
Para una composición determinada, sólo son posibles ciertas fases a una temperatura y presión dadas. El número y el tipo de fases que aparecerán es difícil de predecir y habitualmente se determina experimentalmente. El resultado de estos experimentos se suele representar en un diagrama de fases.
- Fusión.
Al aumentar la temperatura de un sólido (suministrando energía térmica), sus partículas aumentan las vibraciones, se mueven más rápidamente, y la distancia entre ellas (en general) aumenta. Hasta cierto punto, las fuerzas de Van der Waals son capaces de mantenerlas en su sitio en la red cristalina y el material sigue siendo sólido. Pero si se continúa suministrando calor, llega un momento en que se alcanza lo que se denomina punto de fusión, la amplitud de la vibración de las partículas es tal que la estructura reticular del sólido se rompe parcialmente y comienzan a aparecer grupos de partículas que se pueden mover libremente.
- Solidificación.
Con la caída de la temperatura, el movimiento de las partículas y la distancia que las separa disminuye. Además, también disminuye la energía cinética de rotación.
Al llegar a la llamada temperatura de solidificación , la distancia entre las partículas es tan pequeña que se bloquean mutuamente e interaccionan unas con otras mediante las fuerzas de Van der Waals más intensamente, aumentando las fuerzas atractivas de manera que las partículas se ven forzadas a ocupar una posición fija en una red tridimensional.
Hay líquidos que se expanden cuando la temperatura desciende, el agua es un ejemplo; por ello, si congelamos una botella llena de agua es posible que se rompa el vidrio debido al aumento del volumen del agua sólida. Este comportamiento se conoce como anomalía de densidad del agua.
- Evaporación y sublimación.
La velocidad de las partículas no es la misma para todas, unas son más rápidas y otras se mueven más despacio que la media. La velocidad de las partículas cambia constantemente como consecuencia de las colisiones.
En la frontera de un sólido o de un líquido, se puede producir la transición de fase hacia un estado gaseoso; a veces, puede ocurrir que una partícula al azar reciba un impulso tan fuerte que supere la fuerza de cohesión que la mantenía unida a las otras, y escape.
Esta partícula que escapa pasa a ser en estado gaseoso y toma un poco de energía calorífica en forma de energía cinética; por tanto, como consecuencia de esta partícula que escapa del sólido o del líquido, estos se enfrían un poco. Cuando se alcanza el punto de sublimación o el punto de ebullición, este proceso se realiza de forma continua hasta que todas las partículas pasan a la fase gaseosa.
En este caso, la temperatura en la fase de evaporación acostumbra a ser la misma, dado que todas las partículas están desapareciendo a la temperatura más alta del sistema. El calor se utiliza para aumentar de la entropía .
Si las fuerzas de cohesión son muy fuertes, como en el caso de los enlaces metálicos y los iónicos , no es posible que se produzca la evaporación.
El fuerte incremento en el volumen que conlleva la evaporación de una sustancia puede provocar una explosión si se aplica mucho calor de repente.
- Condensación y deposición.
Los procesos inversos son la condensación y la deposición. Cuando, por casualidad, una partícula impacta contra una sustancia sólida o líquida, le transmite su momento (su energía cinética) y queda atrapada por las fuerzas de cohesión (fuerzas de Van der Waals). Como consecuencia de ello, la sustancia que recibe los impactos se calienta un poco.
Al bajar la temperatura de un gas, las partículas pierden su energía cinética; al alcanzar los límites que marcan la temperatura de sublimación o de solidificación, las partículas comienzan a agruparse entre sí para formar un líquido o un sólido debido a las fuerzas de cohesión que ahora son lo suficientemente fuertes para retener juntas.
- Diagrama de fases
Un diagrama de fases de presión y temperatura (pT) de una sustancia describe la forma en que, en función del valor de la presión y la temperatura, la sustancia se encuentra en una u otra fase o estado físico. Las líneas indican a qué presión y temperatura la sustancia cambia de estado físico.
Las líneas indican las fronteras entre diferentes fases y son los puntos de presión y temperatura en los que se producen las transiciones de fase. En cada fase, la sustancia se encuentra en equilibrio dinámico con respecto a las otras.
Mezclas de materia en diferentes estados.
En los sólidos cristalinos, los átomos o las moléculas que los componen están empaquetados y son muy cercanos. En mineralogía y cristalografía, una estructura cristalina es un arreglo particular de los átomos en un cristal. Una simetría específica está formada por una red de Bravais, que suele ser una única célula unitaria que se repite periódicamente en las tres dimensiones de la red cristalina.
Los sólidos no cristalinos o amorfos se describen a menudo como líquidos sobre refredats que poseen al mismo tiempo las propiedades mecánicas de los sólidos y los líquidos, dependiendo de la escala de tiempo que se considere.
En su estructura, sus moléculas no presentan el orden que encontramos en las sustancias cristalinas. Además, este tipo de sólidos presentan un cierto flujo viscoso y deformación plástica a escala geológica. Por lo tanto, mecánicamente, se comporta como un sólido para todos los propósitos prácticos y escalas de tiempo experimentales. Algunos ejemplos comunes son el caucho sintético, el poliestireno y otros polímeros.
Muchos sólidos amorfos convierten líquidos cuando se calientan por encima de su temperatura de transición vítrea, por encima de la cual las moléculas se vuelven móviles.
Cristal líquido.
El cristal líquido es un tipo especial de estado de la materia que presenta propiedades de las fases líquida y sólida a la vez. Dependiendo del tipo de cristal líquido, es posible, por ejemplo, que las moléculas tengan libertad de movimiento en un plano, pero no entre planos, o que tengan libertad de rotación, pero no de traslación. Algunos tipos de cristal líquido tienen una gran importancia tecnológica, como los utilizados en la fabricación de las pantallas de cristal líquido.
Ordenación magnética.
Los metales de transición a menudo tienen un momento magnético debido a la espín neto de los electrones que se mantienen desparejados y no forman enlaces químicos. En algunos sólidos, los momentos magnéticos de diferentes átomos están ordenados y pueden crear ferromagnetismo, antiferromagnetismo o ferrimagnetismo.
En un material ferromagnético como el hierro sólido, el momento magnético de cada átomo está alineado en la misma dirección (en un dominio magnético).
Si los dominios también están alineados, el sólido es un imán permanente, que es magnético incluso en ausencia de un campo magnético exterior. La magnetización desaparece cuando el imán se calienta hasta la temperatura de Curie, que en el caso del hierro es de 768 ° C .
Un material antiferromagnético tiene dos redes iguales, pero con momentos magnéticos opuestos que se cancelan entre sí, de modo que la magnetización neta es nula. Por ejemplo, en el óxido de níquel II (NiO), la mitad de los átomos de níquel tienen momentos alineados en una dirección y la otra mitad en la dirección opuesta.
En un material ferrimagnéticos, las dos redes de los momentos magnéticos son opuestas, pero desiguales, por lo que la cancelación es incompleta y hay una magnetización neta diferente de cero. Un ejemplo es la magnetita (Fe 3 O 4 ), que contiene iones de Fe 2+ y de Fe 3+ con momentos magnéticos diferentes.
5.1. Estados de Alta Energía.
- Plasma.
Al plasma, se le llama también “el cuarto estado de la materia”, además de los tres “clásicos”, sólido, líquido y gas. Es un gas en el que los átomos se han roto, y que está formado por electrones negativos y por iones positivos, átomos que han perdido electrones y han quedado con una carga eléctrica positiva y que están moviéndose libremente.
A diferencia de los gases fríos (pe, el aire a la temperatura ambiente), los plasmas conducen la electricidad y son fuertemente influidos por los campos magnéticos.
La lámpara fluorescente, muy utilizado en el hogar y en el trabajo, contiene plasma (su componente principal es el vapor de mercurio) que calienta y agita la electricidad, mediante la línea de fuerza a la que está conectado el luz.
La línea hace positivo eléctricamente un extremo, y el otro, negativo, debido a que los iones (+) se aceleren hacia el extremo (-), y que los electrones (-) vayan hacia el extremo (+).
Las partículas aceleradas ganan energía, colisionan con los átomos, expulsan electrones adicionales y así mantienen el plasma, incluso aunque se recombina partículas.
Las colisiones también hacen que los átomos emitan luz y, de hecho, esta forma de luz es más eficiente que las lámparas tradicionales. Los rótulos de neón y las luces urbanos funcionan por un principio similar y también se usan en electrónica.
- Plasma de quarks y gluones.
Los experimentos llevados a cabo en el CERN durante las décadas del 1980 y la del 1990 llevaron a anunciar la existencia de este nuevo estado de la materia en 2000.
El plasma de quarks y gluones es un estado que sólo existe a altas temperaturas y presiones y en el que los quarks y gluones son casi libres, a diferencia de otros estados donde son confinados los hadrones, y pueden ser observados de manera individual.
5.2. Estados a Bajas Temperaturas.
- Superfluido.
El superfluido es un estado de la materia que se caracteriza por la ausencia total de viscosidad, lo que lo diferencia de una sustancia muy fluida, la cual tendría una viscosidad cercana a cero, pero no exactamente igual a cero, por lo que , en un circuito cerrado, fluiría interminablemente sin fricción.
Fue descubierta en 1937 por Pyotr Leonidovich Kapitsa, John F. Allen y Don Miseno, y su estudio se denomina hidrodinámica cuántica. Es un fenómeno físico que tiene lugar a muy bajas temperaturas, cerca del cero absoluto, límite en el que cesa toda actividad. Un inconveniente es que casi todos los elementos se congelan a estas temperaturas.
Pero hay una excepción: la del helio. Hay dos isótopos estables del helio, el helio-4 (que es muy común) y el helio-3 (que es raro) y se produce en la desintegración beta del tritio en reactores nucleares. También se encuentra en la superficie de la Luna, arrastrado hasta allí por el viento solar.
- Condensado de Bose-Einstein.
Otro estado de la materia es el condensado de Bose-Einstein (CBE), predicho en 1924 por Satyendra Nath Bose y Albert Einstein, y obtenido en 1995 (los físicos Eric A. Cornell, Carl E. Wieman y Wolfgang Ketterle compartieron el premio Nobel de Física del año 2001 por este hecho).
Este estado se consigue a temperaturas cercanas al cero absoluto y se caracteriza por el hecho de que todos los átomos se encuentran en el mismo lugar, formando un superàtomo.
5.3. Otros Estados de la Materia.
Existen otros posibles estados de la materia; algunos de estos sólo existen bajo condiciones extremas, como en el interior de estrellas muertas, o al comienzo del universo, después del big bang:
- Fluidos supercríticos. Un fluido supercrítico (FSC) es cualquier sustancia que se encuentre en condiciones de presión y temperatura superiores a su punto crítico . Tienen unas propiedades típicas, lo que habitualmente se denomina “un híbrido entre un líquido y un gas”, es decir, se puede difundir como un gas, y disolver materiales como un líquido. Los FSC se caracterizan por la gran cantidad de densidades que pueden adoptar. Por encima de las condiciones críticas, pequeños cambios en la presión y la temperatura en producen grandes cambios en la densidad.
- Supersólido. Este material es un sólido en el sentido de que la totalidad de los átomos del helio – (4) que lo componen están congelados en una película cristalina rígida, de forma parecida a como lo están los átomos y las moléculas en un sólido normal como el hielo. La diferencia es que, en este caso, el término “congelado” no significa “estacionario”. Como la película de helio-4 es muy fría, apenas un décimo de grado sobre el cero absoluto, comienzan a imperar las leyes de la incertidumbre cuántica. En efecto, los átomos de helio comienzan a comportarse como si fueran sólidos y fluidos a la vez. De hecho, en las circunstancias adecuadas, una fracción de los átomos de helio comienza a moverse a través de la película como una sustancia conocida como superfluido, un líquido que se mueve sin fricción. De ahí su nombre de supersólido .
- Materia degenerada. Se llama materia degenerada aquella en la que una fracción importante de la presión proviene del principio de exclusión de Pauli, que establece que dos fermiones no pueden tener los mismos números cuánticos. Según las condiciones, la degeneración de diferentes partículas puede contribuir a la presión de un objeto compacto, por lo que una enana blanca es sostenida por la degeneración de electrones, mientras que una estrella de neutrones no colapsa debido a la efecto combinado de la presión de neutrones degenerados y la presión debida a la parte repulsiva de la interacción fuerte entre bariones.
- Condensado fermiónico. Creado en la Universidad de Colorado por primera vez en 1999, el primer condensado de fermi formado por átomos fue creado en 2003. El condensado fermiónico, considerado como el sexto estado de la materia, es una fase superflua formada por partículas fermiòniques a temperaturas bajas. Está muy relacionado con el condensado de Bose-Einstein. A diferencia de los condensados de Bose-Einstein, los fermiones condensados se forman utilizando fermiones en lugar de bosones. Dicho de otro modo, el condensado de fermi es un estado de agregación de la materia en la que la materia adquiere superfluidez. Se crea a muy bajas temperaturas, muy cerca del cero absoluto.
- Plasma quarks y gluones. El plasma de quark-gluones (QGP) es una fase predicha por la cromodinámica cuántica (QCD) que existe cuando la temperatura y / o la densidad son muy elevadas. Este estado es compuesto de quarks y gluones, casi libres, que son los componentes básicos de la materia. Se cree que existió durante los primeros 20 a 30 microsegundos después de que el universo naciera en el momento del big bang. Los experimentos en el Super Proton Synchrotron (SPS) del CERN trataron primero de crear QGP en los años ochenta y noventa, y se pudo conseguir de manera parcial. Actualmente, experimentos en el Colisionador de Iones Pesados relativista ( RHIC) del Laboratorio Nacional Brookhaven(Estados Unidos) continúan este esfuerzo. Tres nuevos experimentos se llevan a cabo en el Gran Colisionador de Hadrones (LHC) del CERN, ALICE, ATLAS y CMS, y se continúa con el estudio de las propiedades del QGP.
- Materia extraña o materia de quarks. En química nuclear, física de partículas y astrofísica, el término se usa de dos maneras, una más amplia y la otra más específica. El significado más amplio es sólo materia de quarks que contiene tres “tipos” de quarks: arriba, abajo y extraño. En esta definición, hay una presión crítica y una densidad crítica asociada, y cuando la materia nuclear (hecha de protones y neutrones) se comprime más allá de esta densidad, los protones y neutrones se disocian en los quarks que los componen, resultando así materia de quarks (probablemente, materia extraña). El significado más estricto se refiere a la materia de quarks, que es más estable que la materia nuclear. La idea de que esto podría pasar es la “hipótesis de la materia extraña” de Bodmer y Witten. En esta definición, la presión crítica es cero: el verdadero estado fundamental de la materia es siempre materia de quarks. Los núcleos que vemos en la materia que nos rodea, que son “gotas” de materia nuclear, son necesariamente metaestables, y dado el tiempo suficiente (o el estímulo externo adecuado) decayó en gotas de materia extraña, los strangelets.
Advertencia: no pase a la siguiente Unidad sin haber contestado el Banco de Preguntas de esta unidad. REcuerde que la programación establece el estudio de una guía por semana.
Ir a la Unidad 12 - VI, titulada HISTORIA DE LA LITERATURA COLOMBIANA.